En Bob Esponja hay un episodio en el que Bob Y Patricio están discutiendo, y en medio de la discusión, Patricio totalmente fuera de sí le grita a Bob:
-«Y TÚ ERES UN PAVO»,
a lo cual Pantalones Cuadrados responde:
-¡¿Qué es eso?!,
y Patricio, desbordando su cólera, remata:
-¡LO QUE TÚ ERES!.

A esto se le llama tautología, y es la utilización de un concepto para definir el mismo concepto. Es una repetición absurda y viciosa. Esta clase de construcciones lógicas (-¿ilógicas?-) se evitan a toda costa en los cursos formales de ciencias. Y con buena razón; la física no va por ahí diciendo que los cuerpos son acelerados por fuerzas, y que las fuerzas son los entes que aceleran cuerpos. Sin embargo, como mi madre no crió a un cobarde, no me va dar miedo usar tautologías en la extensión de esta entrada del blog. Esto debido a que, en primer lugar, esto no es un curso formal de física; para eso hay muy buenos libros que se pueden consultar en otras partes -y recomiendo hacerlo-. Y segundo, porque a algunas mentes les resulta muy útil pensar de formas extravagantes a la hora de reflexionar sobre conceptos físicos. La tarea de reflexionar sobre la naturaleza de las cosas y tratar de responder todos los por qués, es una tarea muy recomendable para todo estudiante de ciencias. Se trata de pensar sin miedo y reflexionar profundamente, y esto se lo recomiendo a todo el mundo. Por último, este blog es un repositorio de ideas que me han servido y me siguen sirviendo, y recurro a estos textos de vez en cuando para resolver mis propias dudas. Sin más, comenzamos.
Consideremos un sistema termodinámico como una porción de materia, con su respectiva energía interna, y que ocupa un volumen limitado. Como se ha mencionado anteriormente, la composición material de nuestro sistema termodinámico no es de interés (no nos interesa su estructura microscópica, solo su presencia macroscópica). [Véase PUNTOS DE VISTA MACROSCÓPICO Y MICROSCÓPICO].
En mecánica clásica, el problema general queda resuelto cuando podemos parametrizar las coordenadas generalizadas y las velocidades generalizadas de los sistemas mecánicos. Dicho en español, cuando determinamos matemáticamente las coordenadas y velocidades como función del tiempo. Como analogía, en Termodinámica lo que buscamos es determinar la relación que existe entre las coordenadas termodinámicas del sistema. De esta manera, podremos describir el comportamiento del sistema termodinámico ante cualquier tipo de cambio de estado. Entendamos por cambio de estado, al cambio de cualquiera de sus coordenadas. Ahora bien, ¿qué son esas coordenadas termodinámicas?. Bueno, la respuesta es sencilla pero primero hay que decir lo que no son. Las coordenadas termodinámicas no son coordenadas en el sentido de la mecánica. No carguemos con ese lastre conceptual. Las coordenadas termodinámicas son cantidades físicas que definen el estado en el que se encuentra el sistema termodinámico en cuestión. Como ejemplo, pensemos en un gas ideal.
Para un gas ideal, existen tres cantidades que definirán su estado termodinámico; a saber, su volumen, su presión y su temperatura. Para tener una descripción termodinámica completa de ese sistema de gas ideal, es necesario determinar la forma en la que se relacionan esas tres cantidades que son las coordenadas termodinámicas del sistema. Para este caso en particular, sabemos que si calentamos el sistema, es posible que el gas se dilate e incremente su tamaño. Sin embargo, si el gas se encuentra confinado en un tanque rígido, entonces el volumen del gas permanecerá siempre constante. Esto es el equivalente a una constricción en mecánica. Si el gas tiene entonces volumen constante, y lo calentamos (incrementamos su temperatura), entonces lo que sucederá es que aumentará la presión interna del mismo. También es cierto que si mantenemos la temperatura del gas constante y lo presionamos, reducirá su volumen. De esta manera vemos que existe una relación entre las tres coordenadas termodinámicas. Es posible determinar una ecuación matemática que exprese la relación de forma precisa (se le conoce como ecuación de estado); sin embargo no es el propósito de este artículo. Otra cosa que es importante mencionar ahora es que el volumen del gas ideal es una cantidad extensiva, mientras que la presión es una cantidad intensiva.
Anteriormente abordamos el gas ideal como ejemplo de sistema termodinámico; sin embargo solo fue como un ejemplo muy particular, ya que existen infinidad de sistemas termodinámicos que se pueden estudiar, como sales paramagnéticas, alambres tensionados, etc. A la hora de estudiar distintos sistemas termodinámicos existe siempre una similitud; las coordenadas termodinámicas obedecen el siguiente patrón: una de ellas es intensiva, otra extensiva, y la temperatura siempre será considerada como una coordenada termodinámica más. Hay que recordar que la temperatura juega un rol primordial en la termodinámica. Si no consideramos a la temperatura, básicamente estamos estudiando otra área de la física, no termodinámica.
Así pues, pensemos ahora en un par de sistemas termodinámicos. Pueden ser dos sistemas cualquiera, objetos comunes. Pueden ser una pelota y un sartén, una chuleta de cerdo y un bloque de asfalto, un tenedor y un vaso de agua… lo que sea. Ahora bien, llamemos a estos sistemas termodinámicos, Sistema A y Sistema B, e imaginemos que estos se encuentran a temperaturas diferentes. Así diremos que por ejemplo, el Sistema A está caliente mientras que el B está frío. Estudiemos qué sucede cuando estos dos sistemas son aislados del resto del universo, de forma tal que nuestro objeto de estudio serán solo los dos sistemas y la frontera que los divide uno del otro. Todo lo demás queda fuera de nuestra consideración ahora mismo. Estamos estudiando por ejemplo, un bloque de hierro caliente y un bloque de cobre frío, y no nos interesa si están en Cancún o en Miami. Por nuestra experiencia cotidiana sabemos lo que sucede si ponemos en contacto dos cuerpos de diferente temperatura. El cuerpo frío tiende a calentarse, y el cuerpo caliente tiende a enfriarse. Ambos sucesos ocurren de forma simultanea. El resultado es que ambos cuerpos terminan llegando a una temperatura intermedia entre las temperaturas que tenían ambos al inicio del experimento. Esto proceso de cambio de temperatura puede llevar algún tiempo, pero cuando se alcanza esa temperatura final, que es igual en ambos cuerpos, ya no vuelven a haber cambios de temperatura en ninguno de los dos. De hecho, si las condiciones externas no cambian, tampoco habrán cambios en ninguna de las coordenadas termodinámicas de ninguno de los sistemas; y esto tenderá a mantenerse así, sin importar el tiempo que pase. Cuando un sistema termodinámico llega a este estado en el cual todas sus coordenadas se mantienen constantes en el tiempo, se dice que el sistema alcanzó el estado de Equilibrio Térmico. Todos estamos familiarizados con este tipo de experiencias en nuestra vida cotidiana.
Sin embargo, es posible que los dos sistemas termodinámicos que estamos estudiando estén separados por una pared que delimita la frontera física entre ellos. Además, puede darse el caso de que dicha pared sea de un material «aislante»; que sea un aislante térmico, o bien, que no permita el paso de «calor» de un cuerpo a otro. Aquí precisamente estoy adelantándome en los conceptos, pero quiero hacerlo para simplificar el lenguaje. El calor es la energía que se transmite de un cuerpo caliente a un cuerpo frío, y ya. Que por el momento baste con esto. Un estudio sobre el concepto de calor merecerá la pena en una entrada futura. Cuando digo que un aislante térmico mitiga el transporte de calor, lo que me estoy ahorrando es decir que el aislante es un material tal que al hacer las veces de pared divisoria entre las fronteras de un sistema caliente y un sistema frío, inhibe el cambio de temperatura de cualquiera de los sistemas. Esto es mucha jerga y creo que de manera intuitiva todos tenemos una noción más bien correcta del calor. Materiales aislante conocemos muchos en la vida cotidiana, como la madera que recubre los mangos de los sartenes para evitar que nos quememos las manos; o bien los forros que se colocan en los vasos para sostener bebidas ya sea muy calientes o muy frías. Imaginemos nuestra mano fría en invierno sosteniendo un café hirviendo dentro de un vaso aislante; ni nuestra mano se calentará, ni el café se enfriará. A esto nos referimos cuando hablamos de una pared aislante separando dos sistemas, uno caliente y uno frío.
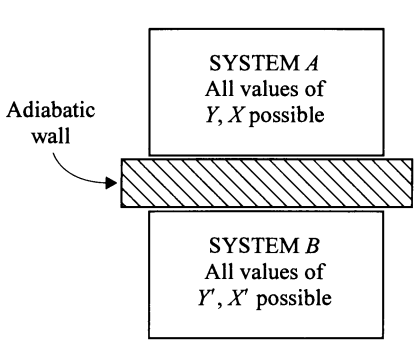
Después de tanta verborrea posiblemente innecesaria, pongamos nuestra atención en la siguiente figura. En ella se observan dos sistemas termodinámicos, llámense A y B. Ambos sistemas tienen en general diferentes temperaturas T y T’, y tienen diferentes coordenadas termodinámicas X y Y para A, y X’ y Y’ para B. Las coordenadas X y X’ pueden ser consideradas extensivas (volumen en el caso del gas ideal) y las coordenadas Y y Y’ pueden ser consideradas intensivas (presión en el caso del gas ideal). Si la frontera entre ambos sistemas está delimitada por una pared aislante, también llamada Pared Adiabática, entonces los dos sistemas, uno frío y uno caliente, no podrán compartir calor, pues están aislados por virtud de la pared adiabática. Así, no habrá cambios en ninguno de los dos sistemas, y se puede decir que por lo tanto ambos sistemas están en un estado de equilibrio propio. Sus coordenadas termodinámicas (T,X,Y) y (T’,X’,Y’) permanecerán inamovibles pero en general distintas entre sí, mientras esa pared adiabática siga aislando a los sistemas A y B.
Ahora consideremos una pared conductora de calor. A este tipo de paredes, los nerds las llamamos Paredes Diatérmicas. Un ejemplo sería una placa de aluminio. Por experiencia propia sabemos que una placa de aluminio que separe a nuestros dedos de la llama de la estufa, no nos hace sentir precisamente seguros. ¡Por eso todos volteamos las tortillas con mucho miedo!. Entonces, si consideramos que los sistemas A y B, uno caliente y uno frío, se ponen en contacto entre sí, estando delimitada su frontera solo por una pared diatérmica, podemos esperar que haya intercambio de calor. Así pues, el cuerpo caliente se volverá más frío y el frío se volverá más caliente. Es decir, Las temperaturas de ambos sistemas eran originalmente T y T’, diferentes en general, pero tenderán a ser una misma temperatura T», idéntica para ambos sistemas. Cuando esto suceda, ya no habrán cambios de temperatura y ambos sistemas habrán llegado a sus respectivos estados de equilibrio, compartiendo una misma temperatura T».
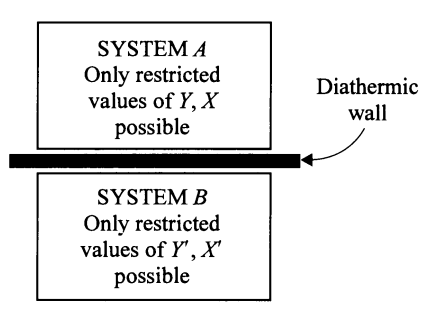
(NOTA: Una pared diatérmica podría ser incluso NADA. Es decir, que decimos que existe una pared diatérmica como frontera entre dos sistemas incluso si realmente no hay nada físico que los separe. Pero esto se aplica solo cuando tenemos control de que los sistemas no se mezclen entre sí. Por ejemplo, si los sistemas considerados son un bloque de cobre y un bloque de hierro; en este caso podemos ponerlos simplemente en contacto, uno encima del otro, y podríamos decir que están separados por una pared diatérmica. Sin embargo, cuando los sistemas son líquidos o gases, no podemos ponerlos en contacto entre sí y evitar que se mezclen. En esos casos es necesario que la pared diatérmica realmente tenga una presencia física «tangible». La idea de la pared diatérmica es que permita el transporte de calor entre los dos sistemas, pero que no permita el transporte de materia.)
Digamos que entendemos que cuando dos sistemas que en general tienen temperaturas distintas (en general quiere decir que incluso podrían tener la misma temperatura) se ponen en contacto por medio de una pared diatérmica, ambos sistemas tenderán a un estado de equilibrio térmico, y que terminarán compartiendo una misma temperatura de equilibrio. Sin embargo, ¿qué sucede cuando consideramos TRES sistemas termodinámicos A, B y C…? Bueno, esta pregunta puede parecer difícil, pero no lo es una vez que entendemos lo visto hasta este punto. En el siguiente esquema observamos tres sistemas termodinámicos A, B y C, separados del resto del universo por una pared adiabática (es decir que no habrá interacciones termodinámicas entres los tres sistemas y el entorno que los rodea); los sistemas A y B están separados entre sí por una pared adiabática también, así que están aislados termodinámicamente; los sistemas A y C están en contacto termodinámico, pues están en contacto por medio de una pared diatérmica (conductora); los sistemas B y C también están haciendo contacto térmico gracias a una pared diatérmica.
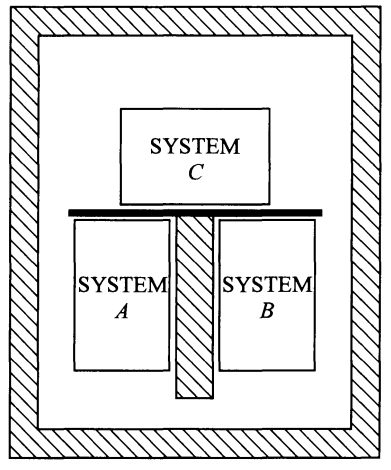
En general los tres sistemas tendrán temperaturas diferentes al inicio; pueden ser Ta, Tb y Tc. Primero enfoquémonos en los sistemas A y C. Al estar estos en contacto térmico, compartirán calor y sus temperaturas eventualmente tenderán a una misma temperatura, que podemos llamar Tac. Sin embargo, como C está también en contacto con B, entonces eventualmente B y C tenderán a una misma temperatura, a la que llamaremos Tabc. El orden del razonamiento anterior es ficticio y es solo para ilustrar un punto. En la vida real, los cambios de temperatura suceden en los tres sistemas de forma simultánea. Todos los sistemas llegarán a una temperatura final Tabc que no cambiará más, y será la temperatura de su estado de equilibrio térmico. No es que se equilibren primero A y C, y después C y B, y al final todos acaben en equilibrio térmico. Simplemente los tres sistemas se acabarán equilibrando de forma simultánea.
En cambio consideremos ahora el siguiente diagrama. En él se observan los mismos sistemas A, B y C, pero ahora A y B están en contacto diatérmico, y tanto A como B están separados de C por una pared adiabática. Lo que sucederá a continuación es muy fácil de prever si se ha entendido lo anteriormente expuesto. A y B tenderán a una misma temperatura final de equilibrio, pero C permanecerá con su temperatura inalterada desde el inicio del experimento. C está en estado de equilibrio desde el inicio de la observación, mientras que A y B alcanzarán el estado de equilibrio solo hasta que sus temperaturas se igualen, y eso lleva un tiempo.
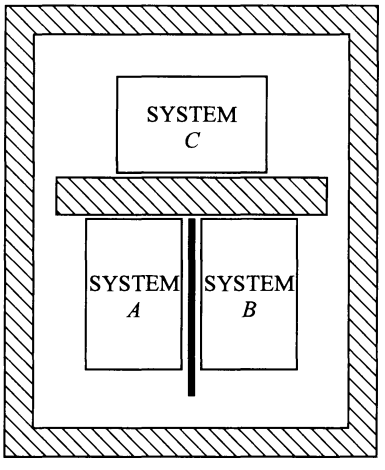
(NOTA: Es importante mencionar que en algunos textos se refiere al equilibrio térmico como el estado de UN sistema en el cual sus coordenadas termodinámicas cesan de variar. En otros textos se define al equilibrio térmico como un estado compartido entre DOS O MÁS sistemas, que al estar en contacto térmico llegan a un estado final en el cual sus temperaturas se igualan y se mantienen constantes. La diferencia radica en si el equilibrio es de un sistema o de varios sistemas en contacto, pero creo que ambos conceptos son sencillos de entender en su contexto, y es importante prestar atención a este detalle.)
Como un resumen de las últimas observaciones que hemos hecho, podemos concluir que «Un par de sistemas termodinámicos que estén en equilibrio térmico con un tercer sistema, están en equilibrio térmico entre sí.». La anterior aseveración, es conocida como la Ley Cero de la Termodinámica. La razón de este nombre es histórica, y se debe a que fue enunciada de manera formal después de que fueran establecidas las Leyes primera y segunda de la termodinámica.




Pingback: ¿Qué es la Temperatura y con qué se mide? ¿Qué es un Termómetro? | Ciencia y Más